Le malattie infettive hanno interessato gli umani fin da quando, 12 000 anni fa, da cacciatori-raccoglitori sono diventati coltivatori e allevatori stanziali, dando così inizio alla sistematica e diffusa manipolazione della natura.
Nel corso della storia umana, vaiolo, morbillo, peste e malaria hanno devastato intere popolazioni, ma l’evento infettivo in assoluto più letale è stato quello prodotto da H1N1, l’influenza “spagnola” del 1918, che ha ucciso più di 50 milioni di persone (equivalenti a 200 milioni, se si aggiustasse per la popolazione mondiale del 2020). In aggiunta ai fattori facilitanti legati alle circostanze in cui versava l’ospite (la concomitanza con l’epilogo di una lunga guerra mondiale), il virus sommava alla propria citolesività la capacità di rendere patogeni batteri silenti situati nelle vie respiratorie dei soggetti colpiti.
Strategie vincenti, a ciascuno la sua
Per fortuna, le sovrainfezioni batteriche sembrano poco rilevanti in Covid-19, unica epidemia successiva alla spagnola di proporzioni planetarie e con una discreta letalità, tanto da portare gli studiosi a ritenere che la storia umana sia ora entrata nell’era pandemica. Come sosteneva Charles Darwin, non sopravvive la specie più forte, né la più intelligente, ma quella che sa reagire meglio ai cambiamenti: l’organismo umano, come scrive il biologo-etologo britannico Richard Dawkins, è solo una “macchina di sopravvivenza” genetica nella competizione tra microbi. Mentre alcuni di essi, come il vibrione del colera, il rotavirus o il micobatterio della tubercolosi, non si sono evoluti verso un’attenuazione della loro patogenicità, sfruttando anzi i sintomi degli infettati (tosse o diarrea) per diffondersi nell’ambiente, altri si sono adattati a una sorta di convivenza pacifica con gli esseri umani. È il caso, per i batteri, del microbiota e, per i virus, dei retrovirus endogeni umani (HERV), che si sono evoluti integrandosi nel DNA, oppure dell’herpesvirus simplex, del cytomegalovirus, del virus Epstein-Barr e del virus varicella-zoster, che restano nei gangli nervosi senza nuocere all’organismo ospite (se non in caso di abbassamento delle difese immunitarie). L’adattamento e l’evoluzione sono massimizzati dall’instabilità genetica nei virus a RNA (quali sono i virus influenzali, i virus di dengue e Zika e altri arbovirus, gli enterovirus e i coronavirus), che hanno una replicazione definita a quasispecie, cioè incline all’errore e, quindi, alla produzione di sciami di varianti mutate.
Dal punto di vista dell’essere umano, la strategia vincente consiste non solo nel frenare la diffusione e il carico di malattia dell’infezione emergente ma nel liberarsi completamente dell’agente patogeno, in modo che non riaffiori in forme altrettanto, o più, contagiose o letali.
Nel caso di SARS-CoV-2, l’impegno è gravoso, dal momento che il virus è nuovo sotto ogni aspetto – clinico, patogenetico e immunologico – e che solo a poco a poco gli studiosi stanno acquisendo nuove “intuizioni”, come David Morens e Anthoy Fauci, entrambi infettivologi a Bethesda, cautamente definiscono i passi avanti nella sua conoscenza.
Malattie emergenti, ri-emergenti e de-emergenti
Si chiama “emergente” una malattia infettiva in precedenza ignota, mentre si chiama “ri-emergente” una già nota ma che ha avuto un aumento d’incidenza, si è diffusa su una diversa e più ampia base geografica oppure vede coinvolti nuovi ospiti o nuovi vettori; sono dette “deliberatamente emergenti” le malattie infettive prodotte dal bioterrorismo e “accidentalmente emergenti” quelle dovute a fughe non intenzionali da laboratorio. Vi è poi una quinta categoria, quella delle malattie infettive “de-emergenti”, cioè eradicate o in via di eradicazione, come il vaiolo o come SARS (che però resta negli ospiti animali e può, quindi, riemergere); sono sotto controllo, se non proprio in via di eradicazione, anche il morbillo, la rosolia, la filariasi e la poliomielite.
L’ampliarsi di quest’ultima categoria segnala che adeguati sforzi scientifici, economici e politici possono essere armi efficaci per combattere sia le epidemie che emergeranno sia quelle che già infestano il pianeta. Non bisogna, infatti, dimenticare che se agli occidentali Covid-19 sembra essere arrivato come un fulmine a ciel sereno, su altri continenti il cielo era già molto temporalesco.
Non lo dimentica l’OMS, che il 30 gennaio di quest’anno ha celebrato la seconda edizione della Giornata mondiale per le malattie tropicali neglette (Neglected Tropical Diseases, NTD), nella quale ha lanciato la propria roadmap 2021-2030 per aumentare il controllo e diminuire la disabilità e i decessi connessi a una ventina di malattie causate da virus, batteri, parassiti, funghi e tossine che infettano oltre un miliardo di persone e causano più di mezzo milione di morti l’anno, soprattutto perché diffuse in popolazioni povere e marginalizzate, con difficile accesso ai sistemi sanitari.
L’Europa stessa non è certo al sicuro: nel mondo globalizzato circolano merci e persone e, con esse, anche malattie; inoltre, i disastri ambientali creano le condizioni per una maggiore contiguità delle popolazioni alle fonti d’infezione. Già in epoca pre Covid-19, proponevo ai partecipanti a un corso di Formazione specifica in medicina generale un approfondimento sulle malattie infettive emergenti e ri-emergenti, reputando che fossero d’interesse anche per i medici del territorio, in considerazione del numero sempre più alto di persone che si muovono da un paese o, addirittura, da un emisfero all’altro, per lavoro o per vacanza.
Dell’entità di questi spostamenti può dare un’idea la mappa delle rotte dell’aviazione civile nel 2009, utilizzata in un articolo scritto dal biologo evoluzionista dell’Università della California A.M. Kilpatrick e dallo zoologo dell’Università di Oxford S. E. Randolph.
Mappa del traffico aereo aggiornata al 2019. Fonte: https://gis.icao.int/gallery/TRAFFICFLOW2019zoomsimpOP.pdf
Nel dipartimento Malattie infettive dell’ISS è attivo il laboratorio di riferimento nazionale per gli arbovirus; le più importanti malattie d’importazione di cui il laboratorio effettua la diagnosi sono dengue, chikungunya, febbre gialla, West Nile, encefalite giapponese e quelle causate da hantavirus. In periferia, però, ogni medico dovrebbe conoscere i rischi per la salute dei viaggiatori (al fine di prescrivere misure precauzionali e profilassi) ed essere in grado di ipotizzare le possibili cause di sintomi apparentemente comuni insorti durante o dopo il viaggio e di valutarne la prognosi.
Secondo una revisione di 112 studi pubblicata su JAMA, per esempio, la cosiddetta diarrea del viaggiatore, espressione di un’enterite acuta batterica, virale o protozoaria, non sempre è un disturbo banale, perché, se non trattata adeguatamente, può dare origine a una sindrome del colon irritabile nel 17% dei casi.
D’altronde, solo di Escherichia coli sono noti ben 171 sierotipi, che spaziano da quello saprofita intestinale degli animali a sangue caldo in genere, nei quali aiuta il processo digestivo, al ceppo enteroemorragico che nel 10% dei bambini colpiti provoca la sindrome emolitico-uremica, con anemia, piastrinopenia e insufficienza renale acuta.
Anche la febbre ha un’origine e un peso diversi in rapporto all’area geografica visitata da chi ne è affetto: nei Caraibi, nelle Americhe centrale e meridionale, nel Sudest asiatico e nell’Africa subsahariana possono essere in causa dengue, chikungunya, malaria, rickettsiosi e zika.
Le zoonosi
Tutte queste malattie (e il 70% di tutte le malattie infettive emergenti che hanno colpito gli esseri umani negli ultimi vent’anni) sono zoonosi, ossia il risultato del trasferimento di un agente patogeno da animali alle persone o per via alimentare o tramite le loro deiezioni o con punture (e, talvolta, morsi) di animali vettori. Il ruolo di vettore può essere stabilito in via sperimentale, oppure perché il vettore viene trovato regolarmente infetto dal patogeno in natura, oppure perché c’è corrispondenza geografica tra vettore e patogeno o, infine, perché la preferenza trofica del vettore coincide con gli ospiti del patogeno.
Alcuni vettori sono in grado di coprire grandi distanze, ampliando il raggio d’azione dei patogeni veicolati, mentre altri penetrano passivamente in nuove aree geografiche tramite gli spostamenti compiuti dalle persone, gli scambi commerciali internazionali, il trasporto di bestiame, la migrazione degli uccelli, le variazioni delle pratiche agricole, il vento. Se il clima è favorevole, i vettori persistono e si diffondono nelle aree d’arrivo.
Zanzare e virus, da Chikungunya a Zika
In cima alla lista dei vettori ci sono le zanzare; ne sono note 3 564 specie, alcune delle quali sono vettori di arbovirus, protozoi (malaria) e nematodi (filaria). Della sessantina di tipi che vive in Italia, alcune, come Aedes albopictus, detta zanzara tigre in quanto nera a strisce bianche, e Aedes aegypti sono di recente importazione e responsabili di focolai autoctoni di sindbis, chikungunya, dengue e West Nile; le zanzare nostrane più comuni sono la Culex pipiens (dal fastidiosissimo ronzio, che punge di sera e al mattino presto nelle aree urbane, si riproduce in ristagni d’acqua e si sposta poco), la più grossa Anopheles claviger (tipica degli ambienti rurali con stagni e paludi) e la zanzara di risaia Ochlerotatus caspius, che si sposta in sciami anche per diversi chilometri, infestando ampie aree la sera per poi sparire prima di notte.

La distribuzione di A. albopictus in Europa nel 2020. Fonte: ECDC
Aedes albopictus che, come si vede nella mappa, ha trovato un ambiente propizio in tutta la penisola italica, ha un grande vantaggio evolutivo: produce uova che possono andare in diapausa, con arresto dello sviluppo nei periodi freddi e schiusa quando le condizioni diventano favorevoli. La grande resilienza di questi insetti fa sì che la lotta contro di essi abbia dovuto assumere connotati biotecnologici, puntando sulla modificazione genetica; Andrea Crisanti, per esempio, ha sperimentato all’Imperial College di Londra la produzione di maschi di Aedes albopictus sterili.
In base ai dati presentati all’European Congress of Clinical Microbiology & Infectious Diseases (ECCMID) tenutosi ad Amsterdam nell’aprile 2019, è in rapida espansione l’areale geografico di molte malattie da vettore: ne sono un esempio chikungunya e dengue, due malattie con possibilità di complicanze emorragiche e di contagio per i contatti stretti e per il personale sanitario (come le più gravi Ebola e Marburg). I virus responsabili, veicolati da Aedes aegypti e A. albopictus, dapprima solo africani e asiatici, hanno poi raggiunto l’Europa, il Nord America e l’Australia, installandosi, in alcuni casi, come infettanti autoctoni.
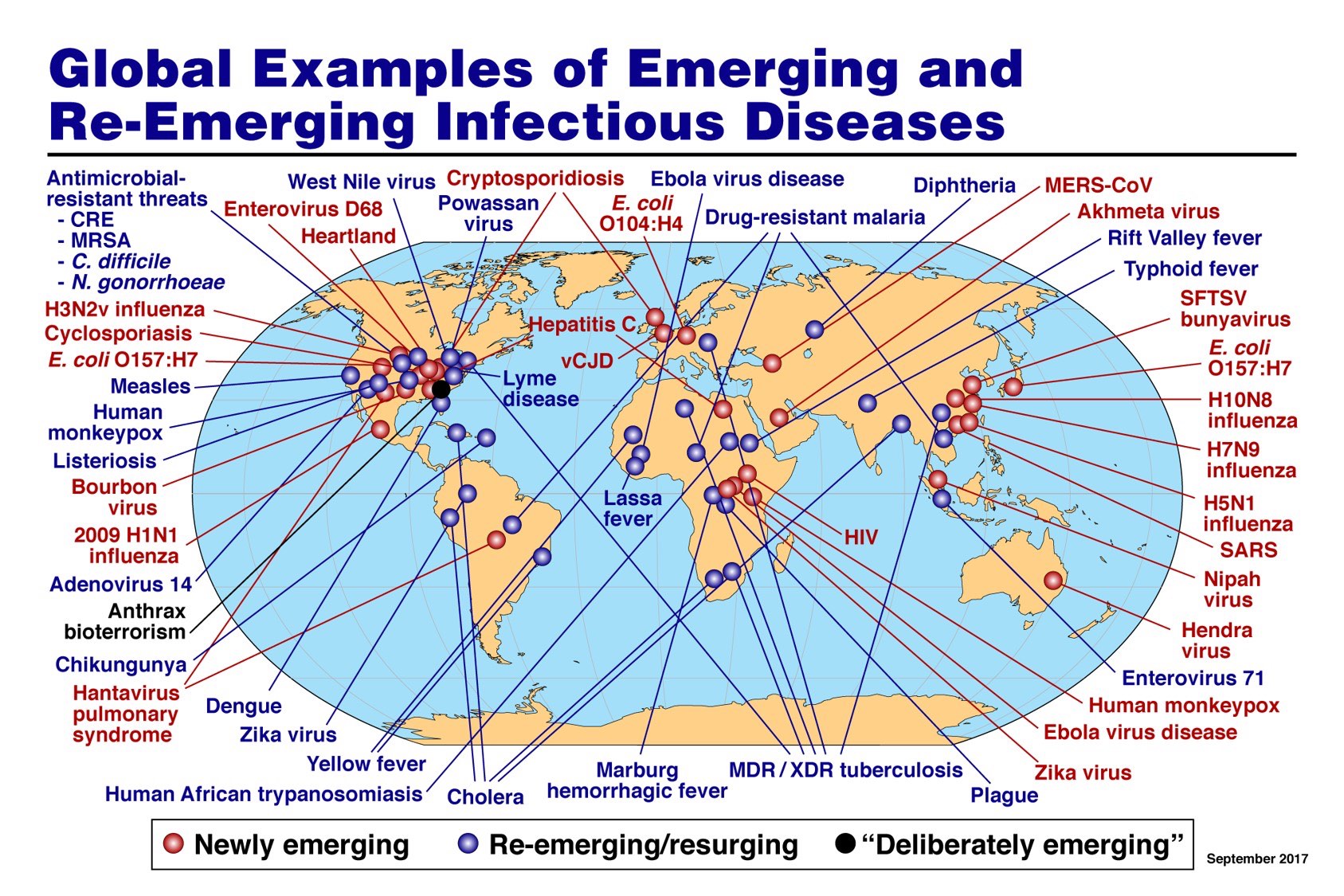
Mappa delle malattie infettive emergenti al 2017. Crediti: Antoni Fauci/Wikimedia Commons
Chikungunya, che in lingua swahili significa “che contorce”, dà febbre e forti dolori articolari e muscolari, che possono cronicizzare in una poliartrite immunologicamente simile all’artrite reumatoide, ma conferisce un’immunità permanente.

Aree in cui sono stati riportati casi di Chikungunya al 2020. Fonte: CDC
La dengue, invece, conferisce un’immunità solo verso il sierotipo del virus che l’ha provocata, ma non verso un sierotipo diverso. Può manifestarsi con la transitoria “febbre rompiossa” oppure come malattia emorragica fatale (gli immunocomplessi tra virus e anticorpi richiamano citochine che aumentano la permeabilità vascolare e inducono coagulazione intravasale disseminata) e il principale fattore di rischio di sviluppare le forme più gravi della malattia è una precedente infezione con un sierotipo diverso del virus DENV: per questo motivo, la dengue raramente è letale per i turisti, ma lo è spesso per i residenti delle zone a rischio, perché possono infettarsi in successione con diversi sierotipi di virus. Purtroppo, non esiste un vaccino per quella che è una delle principali cause di malattia e di morte nei tropici e subtropici: ogni anno s’infettano circa 50 milioni di persone e oltre un terzo della popolazione mondiale vive esposta all’infezione. Oggi è oggetto della sorveglianza dell’OMS la possibilità che la dengue diventi autoctona anche in Europa, dove i suoi vettori sono presenti.
Anche il virus West Nile, isolato in Uganda nel 1937, è ormai diffuso in tutti i continenti; in Italia, ogni estate, vengono segnalati, a seconda degli anni, decine o centinaia di casi di West Nile, in forma per lo più asintomatica, talvolta febbrile e più raramente neuro-invasiva (encefalite). I serbatoi del virus sono gli uccelli selvatici; le zanzare (più frequentemente del genere Culex) lo trasmettono con la puntura agli esseri umani e ai cavalli ed è possibile anche la trasmissione per via ematica, tanto che, dal 2012, in Italia e in Grecia si opera lo screening del virus nei derivati ematici e nei tessuti e organi destinati alla donazione.
In altri casi, non è la migrazione dei vettori ma una mutazione a cambiare le carte in tavola: Zika è un flavivirus veicolato dalle zanzare Aedes aegypti e da Aedes albopictus, identificato nel 1947 in alcune scimmie in Uganda e nel 1952 negli esseri umani in Nigeria e la cui circolazione era abbastanza confinata. Qualche anno fa, la sostituzione di un singolo aminoacido della glicoproteina esterna del virus ha scatenato un’epidemia che ha colpito più di un milione di persone, in circa 30 paesi. Nonostante l’assenza di vittime o di forme clinicamente rilevanti tra gli adulti (l’infezione è asintomatica o si risolve con una settimana di simil influenza), nel periodo ottobre-dicembre 2015 l’OMS ha dichiarato l’emergenza internazionale (Public Health Emergency of International Concern, PHEIC), per la rapida crescita di casi di sindrome congenita conseguente all’infezione virale materna, con microcefalia, anomalie cerebrali, dell’occhio e articolari, paralisi flaccida e piastrinopenia. Il Brasile ha contato 2 400 neonati affetti (contro i 170 dei 5 anni precedenti), 260 dei quali deceduti.
Microbiologia nazista
Una zoonosi trasmessa da zanzare, del tipo Anopheles ma non dovuta a virus, bensì al protozoo Plasmodium malariae, in 4 sottotipi, è la malaria, malattia che era scomparsa in Europa, ma della quale, negli ultimi anni, sono stati segnalati nuovi casi autoctoni. Nella primavera del 1944, per ritardare l’avanzata degli Anglo-Americani e in odio agli Italiani che dall’8 settembre del 1943 erano diventati nemici, i tedeschi invertirono le pompe idrovore che prosciugavano l’Agro Pontino, così che invece di pompare acqua in mare, pompavano acqua marina verso la pianura, formando vasti acquitrini salmastri, ambiente ideale di proliferazione dell’Anopheles labranchiae. Inoltre, requisirono il chinino presente nei magazzini romani. Il piano era stato ideato dai malariologi tedeschi Erich Martini e Ernst Rodenwaldt. Gli Alleati arrivarono comunque a Roma il 4 giugno, ma, nel 1944, gli infettati nell’Agro Pontino furono più di 100 000 su 245 000 abitanti e tra il 1944 e il 1946 gli affetti da malaria erano dieci volte quelli registrati nel 1939 e nel 1940.
Altri vettori: roditori e zecche
Le zanzare non sono gli unici vettori di agenti infettivi: possono rivestire questo ruolo anche pappataci, mosche, topi, zecche e pulci.
Per restare in ambito europeo, le infezioni da Hantavirus hanno come serbatoi e sorgente i roditori selvatici, sinantropi o domestici (con un tipo diverso di Hantavirus associato a ciascuna specie) che infestano il nord (Finlandia e Svezia) e il centro (Balcani, Germania, Francia e Russia). I roditori infetti eliminano il virus per tutto l’arco della vita, disseminandolo nell’ambiente con i loro escreti (urine, feci, saliva); le persone si ammalano aspirandone le particelle disperse nell’aria. Sono a rischio escursionisti, ricercatori che utilizzano roditori selvatici, contadini e boscaioli, addetti alla pulizia di silos e capannoni agricoli.
Le zecche (dure e molli) possono veicolare virus, rickettsie, batteri, protozoi e neurotossine; per questi aracnidi, le persone non sono il bersaglio preferito ma solo occasionale; sopravvivono per molti anni anche a climi rigidi e hanno grande capacità riproduttiva (una femmina depone diverse migliaia di uova), scarsità di nemici naturali e resistenza ai pesticidi. Possono resistere a lungo a digiuno, ma hanno bisogno di sangue per completare lo sviluppo e il ciclo riproduttivo. Il pasto, durante il quale la zecca rimane costantemente attaccata all’ospite, si compie nell’arco di ore per le zecche molli, di giorni o settimane per le dure e la possibilità di trasmissione di agenti patogeni sembra proporzionale al tempo d’infissione sull’ospite. In Italia, le patologie da zecca rilevate sono la febbre bottonosa del Mediterraneo, la borreliosi di Lyme, la febbre ricorrente da zecche, la tularemia e la meningoencefalite da zecche (causata da un flavivirus come quelli della febbre gialla e della dengue e trasmessa da molti tipi di zecche, tra cui quelle del cane); non sembra presente l’ehrlichiosi, invece emergente negli Stati Uniti d’America. Alcune regioni dell’Italia centro-meridionale e insulare (Sardegna, Sicilia, Calabria e Lazio) sono particolarmente interessate dalla rickettsiosi, mentre le regioni maggiormente interessate dalla borreliosi di Lyme sono Friuli-Venezia Giulia, Liguria, Veneto, Emilia-Romagna, Trentino Alto-Adige (probabilmente per mancata segnalazione in altre regioni). La borreliosi è oggi la più diffusa patologia trasmessa da vettore nelle zone temperate. L’agente patogeno è una spirocheta del genere Borrelia, con serbatoio negli animali selvatici (roditori, caprioli, cervi, volpi, lepri) e trasmissione agli esseri umani attraverso la puntura di zecche dure.
Il fattore umano
Per la diffusione di molte delle malattie fin qui citate è possibile rinvenire una responsabilità nell’incapacità dell’essere umano di vivere in armonia con la natura (deforestando, allevando intensivamente, minando la biodiversità con monocolture) e con i suoi simili, privati delle risorse nei luoghi di nascita e spinti a un inurbamento sovraffollato e antigienico, lo stesso che, nel corso dei secoli, ha fatto sì che le infestazioni murine seminassero peste, tifo e rabbia.
Anche i cambiamenti climatici annoverano, tra le molte altre conseguenze, la possibilità che le malattie trasmesse da zanzare si intensifichino in misura drammatica, aumentando sia la sopravvivenza del vettore e il suo tasso di riproduzione, sia la replicazione del patogeno all’interno del vettore e la stagionalità di trasmissione. L’importanza relativa dei cambiamenti climatici rispetto a quella della globalizzazione e dell’urbanizzazione è l’oggetto di un recentissimo studio britannico di modellizzazione che preconizza scenari preoccupanti di diffusione di malaria e Dengue nelle aree un tempo a clima temperato.
fonte: Scienza in Rete






